Tipos de Cristales
La estructura propiedades de como punto de fusión, densidad y dureza están determinado por el tipo de fuerza que mantienen unidas las partículas.
- Cristales Ionicos
El cristal esta formado por iones positivos y negativos unidos entre si mediante fuerzas de naturaleza electrostáticas este tipo de cristal son malos conductores del calor y la electricidad ya que carecen de electrones libre. Pero cuando el cristal es sometido a una temperatura elevada los iones adquieren inmovilidad y aumenta su conductividad eléctrica.
Suelen ser distintos de tamaño, son duros y quebradizos.
- Cristales Covalentes
Los átomos de cristales covalentes se mantiene unidos en red tridimensional únicamente por enlace covalente. Este tipo de cristal son extremadamente duros y dificil de formar, malos conductores del calor y por lo tanto de la electricidad, el calor y la electricidad mantienen una relación directa ya que no existen electrones libres que trasladen energía de un punto a otro.
Diamante cristal típico del enlace covalente.
- Cristales Moleculares
Son sustancia cuya molécula no son polares, la característica de este cristal es que las moléculas están unidas por las denominadas fuerzas Van der Waals, estas fuerzas son muy débiles y corresponde a fuerzas de dipolos eléctricos su conductividad es nula y son bastante deformables.
La calcita es muy común y tiene una amplia distribución por todo el planeta, se calcula que aproximadamente el 4% en peso de la corteza terrestres de calcita. De la clase 05 de la clasificación de Strunz los llamados minerales carbonato nitrato.
- Cristales Metálicos
La estructura de los cristales metálicos es mas simple porque cada punto reticular del cristal esta ocupado por un átomo del mismo metal. Se caracteriza por tener pocos electrones débilmente ligados a sus capas mas externas cargados positiva-mente, su conductividad es excelente tanto térmica como eléctrica debido a sus electrones libres.
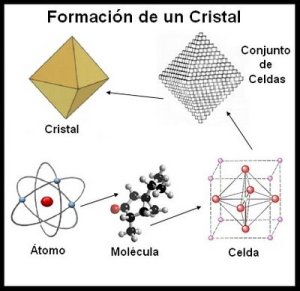
Formación de un Cristal
Técnicas de Difracción de Rayos X
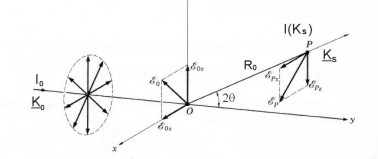
Un haz de rayos “X” no polarizado (es decir, en el que el campo electromagnético está vibrando al azar en todas las direcciones perpendiculares a la de propagación), que incida sobre un electrón, interacciona fundamentalmente a través del campo eléctrico, de forma que, en primera aproximación, podemos despreciar la interacción magnética y la nuclear.
Según la teoría electromagnética de Maxwell, el electrón dispersa ondas eléctricas transversales para el campo eléctrico, de forma tal que la intensidad, como medida de la energía dispersada que atraviesa la unidad de área perpendicular a la dirección de propagación y por unidad de tiempo, es:
Ie(Ks) = I0 [e4 / R02 m2 c4] [( 1 + cos2 2θ) / 2]
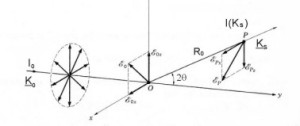
Modelo Dispersión de Thompso
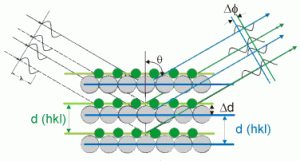
Dos científicos ingleses, William Bragg y su hijo Lawrence, trataron la difracción de los rayos X como si el proceso fuera de reflexión. En el estudio de Bragg se piensa que los rayos X que penetran en un cristal son reflejados, por las capas sucesivas de partículas dentro de la sustancia.
En este diagrama se puede observar que los haces reflejados desde capas más profundas deben viajar más lejos para alcanzar el detector.
Bragg demostró que para demostrar alguna intensidad en los rayos X emergentes, debería cumplirse una relación simple. Esta relación que se conoce como la ecuación de Bragg,

Donde “d” es el espaciamiento entre las capas sucesivas que reflejan los rayos X, es el angulo con el que los rayos X entran y salen del conjunto específico de capas, es la longitud de onda de los rayos X y n es un entero (o sea n= 1, 2, 3, etc.). La ecuación de Bragg sirve como base para el estudio de la estructura cristalina por difracción de rayos X.
En la práctica, se dirigen hacia un cristal rayos X de longitud de onda conocida y se miden los ángulos a los cuales son reflejados, por ejemplo registrándoles sobre un trozo de película fotográfica.
Redes de Bravais
SON CELDAS UNITARIAS QUE CONSTITUYEN QUE CONSTITUYEN LA MENOR DIVISIÓN DE LAS REDES CRISTALINAS QUE CONSERVA LAS CARACTERÍSTICAMENTE GENERALES DE TODA LA RETÍCULA DE MODO QUE POR SIMPLE TRASLACIÓN DEL MISMO PUEDA RECONSTRUIRSE EL SOLIDO CRISTALINO COMPLETO.
Características de las Celdas
En el caso más sencillo, a cada punto de red le corresponderá un átomo, pero en estructuras más complicadas, como materiales cerámicos y compuestos, cientos de átomos pueden estar asociados a cada punto de red formando celdas unitarias extremadamente complejas. En el primer caso, pueden obtenerse sencillamente diversas características de la red cristalina.
- Parámetro de red. Es posible determinar el valor del parámetro de red (longitud de los lados de la celda unitaria) sin más que localizar en la celda la dirección a lo largo de la cual los átomos entran en contacto. A estas direcciones se las denomina direcciones compactas.’
- Número de coordinación. Es el número de átomos que se encuentran en contacto con un átomo en particular, o el número de átomos más cercanos. El máximo es 12.
- Factor de empaqueta miento. Fracción del espacio de la celda unitaria ocupada por los átomos, suponiendo que éstos son esferas sólidas.
| Estructura | a (r) | Número de coordinación |
Factor de empaqueta miento |
Ejemplos |
|---|---|---|---|---|
| Cúbica simple (CS) |
a = 2r | 6 | 0,52 | — |
| Cúbica centrada en el cuerpo (CC) |
a = 4r/√3 | 8 | 0,68 | Fe, Ti, W, Mo, Nb, Ta, K, Na, V, Cr, Zr |
| Cúbica centrada en las caras (CCC) |
a = 4r/√2 | 12 | 0,74 | Fe, Cu, Al, Au, Ag, Pb, Ni, Pt |
| Hexagonal compacta (HC) |
a = 2r c = 1,633 a |
12 | 0,74 | Ti, Mg, Zn, Be, Co, Zr, Cd |
Empaquetado Cubico Compacto
El suponer los átomos como esferas rígidas implica que no todo el volumen de la celda unidad esté ocupado por átomos. Al mismo tiempo, la disposición de los átomos es diferente en función de la dirección o plano de la red que se considere, lo que hace variar la densidad atómica o iónica en función de la dirección o plano de la red. Estas consideraciones llevan a definir una serie de conceptos que permiten cuantificar y comparar la forma en la que los átomos o iones se empaquetan en el interior de la celda unidad de las diferentes redes de Bravais.
El estado sólido de la materia
Los sólidos se forman generalmente cuando un líquido o un vapor se enfrían a una temperatura, lo suficientemente baja, como para que las fuerzas interatómicas o intermoleculares de atracción superen a la agitación térmica.
Muy a menudo el sólido adquiere una forma muy ordenada o cristalina; ello tiende a minimizar la energía libre del sistema de partículas.
Aquellos sólidos en los que la estructura presenta regularidad espacial o periodicidad se conoce como cristalina y los que no poseen ningún tipo de orden se denomina amorfo.
En los gases y en los líquidos las moléculas de manera continua y aleatoria, y además giran y vibran. Debido a este movimiento no es posible que haya un arreglo ordenado de las moléculas en el estado líquido o gaseoso. Sin embargo, en los sólidos las moléculas, átomos o iones no pueden moverse (aunque vibran y ocasionalmente rotan). De este modo, aparece un patrón regular y receptivo de átomos o moléculas en su estructura (un orden de largo rango) que es característico del estado sólido.
La hermosa irregularidad externa (macroscópica) de un cristal de sal sugiere que tiene simetría interna, simetría que incluye los iones que constituyen el sólido. Las estructuras de los sólidos pueden describirse como redes cristalinas tridimensionales de átomos, iones o moléculas. En un sólido cristalino, la celda unitaria es la unidad repetitiva más pequeña que posee toda la simetría característica de arreglo atómico, iónico o molecular.